新闻资讯 了解首宏动态、掌握行业资讯
近年来,国家药监局贯彻落实《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)和《中央办公厅国务院办公厅关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),深入推进医疗器械审评审批制度改革,加速医疗器械创新发展。
对于进入创新医疗器械审评审批通道的产品,国家局通过早期介入、专人负责、多次沟通、专家咨询等方式开展科学审评审批,在“标准不降低、程序不减少”的前提下,对创新医疗器械予以优先办理。据统计,对创新优先平均审评审批时间较其他普通三类首次注册产品平均压缩83天,创新产品从研发到上市的时间进一步缩短。
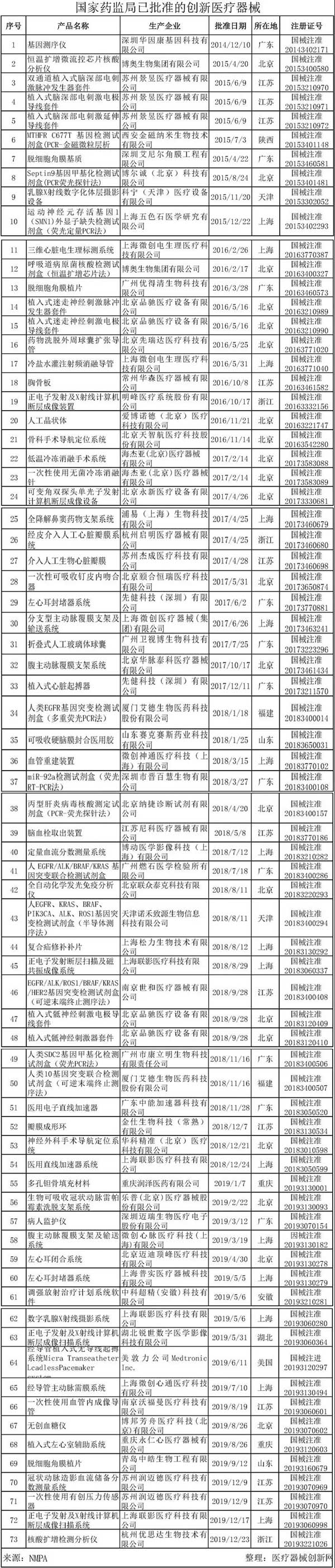
自《创新医疗器械特别审批程序》发布以来,截止2019年12月31日,已有236个产品进入创新医疗器械特别审查通道,73个创新产品获得注册证。
2019年上海微创的 “腹主动脉覆膜支架及输送系统”、上海普实的 “左心耳封堵器系统”的注册、北京迈迪顶峰的“左心耳闭合系统”、 兰州科近泰基的“碳离子治疗系统”、 上海联影医疗的 “正电子发射及X射线计算机断层成像扫描系统”、 杭州优思达的“核酸扩增检测分析仪”等19款创新产品获得国家药品监督管理局批准注册。
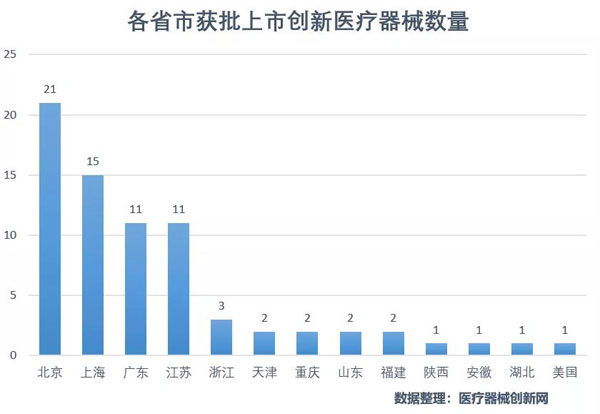
从73个批准产品所在地来看,传统产业大省创新医疗器械数量排名靠前,分别是北京21个、上海15个、广东11个、江苏11个。从批准产品的类型来看,植入类医疗器械33个,诊断类设备14个,体外诊断试剂14个。

首宏医疗控股集团股份有限公司 地址:山东省青岛市南区南京路8号府都大厦 16 层 联系电话:400-699-8388
Copyright @ 2018 Safehigh ALL Right Reserved.
ICP备案:鲁ICP备19047490号-1